Por Sin Reservas
Le compartimos estos conocimientos de trabajos de investigación de laboratorios realizados con el fármaco Ivermectina, el cual está aprobado por la Administración de Medicamentos y Alimentos o Administración de Alimentos y Medicamentos (FDA, sus siglas en inglés).
La FDA es la agencia del gobierno de los Estados Unidos, responsable de la regulación de alimentos, medicamentos, cosméticos, aparatos médicos, productos biológicos y derivados sanguíneos.
Leon Caly,a Julian D. Druce,a Mike G. Catton,a David A. Jans,b and Kylie M. Wagstaffb,∗.
Laboratorio de Referencia de Enfermedades Infecciosas Victorian, Royal Melbourne Hospital, At the Peter Doherty Institute for Infection and Immunity, Victoria, 3000, Australia
Biomedicine Discovery Institute, Monash University, Clayton, Vic, 3800, Australia
RESUMEN
Aunque ahora se están realizando varios ensayos clínicos para probar posibles terapias, la respuesta mundial al brote de Covid-19 se ha limitado en gran medida a la vigilancia / contención. Divulgamos aquí que la Ivermectina, un antiparasitario aprobado por la FDA que previamente demostró tener actividad antiviral de amplio espectro in vitro, es un inhibidor del virus causante (SARS-CoV-2), con una sola adición a las células Vero-HSLAM 2H después de la infección con SARS-CoV-2 capaz de efectuar una reducción de ARN viral de ~ 5000 veces a las 48 h. Por lo tanto, la Ivermectina justifica una mayor investigación sobre posibles beneficios en humanos.
Introducción
La Ivermectina es un «agente antiparasitario de amplio espectro» aprobado por la FDA (González Canga et al., 2008) que, en los últimos años, junto con otros grupos, hemos demostrado tener actividad antiviral contra una amplia gama de virus (Gotz et al., 2016; Lundberg et al., 2013; Tay et al., 2013; Wagstaffet al., 2012) in vitro. Originalmente identificado como un «inhibidor de la interacción entre el virus de inmunodeficiencia humana-1 (VIH-1), la proteína integrasa (IN) y el heterodímero α / β1 de importina (IMP)» responsable de la importación nuclear de IN (Wagstaffet al., 2011), Desde entonces, se ha confirmado que la Ivermectina inhibe la importación nuclear IN y la replicación del VIH-1 (Wagstaffet al., 2012).
Se han informado otras acciones de la Ivermectina (Mastrangelo et al., 2012), pero se ha demostrado que la Ivermectina inhibe la importación nuclear del hospedador (por ejemplo, (Kosyna et al., 2015; van der Watt et al., 2016)) y proteínas virales., incluyendo la proteína no estructural 5 del virus de los simios SV40 (T-ag) y el virus del dengue (DENV) (Wagstaffet al., 2012, Wagstaffet al., 2011).
Es importante destacar que se ha demostrado que limita la infección por virus de ARN como DENV 1-4 (Tayet al., 2013), West Nile Virus (Yang et al., 2020), virus de la encefalitis equina venezolana (VEEV) (Lundberg et al., 2013). ) e influenza (Gotzet al., 2016), y se cree que esta actividad de amplio espectro se debe a la dependencia de muchos virus de ARN diferentes en IMPα / β1 durante la infección (Caly et al., 2012; Jans et al., 2019).
De manera similar, se ha demostrado que «la Ivermectina es eficaz contra el virus ADN de la pseudorrabia (PRV) tanto in vitro como in vivo», y el tratamiento con «Ivermectina ha demostrado que aumenta la supervivencia en ratones infectados con PRV» (Lv et al., 2018).
No se observó la eficacia de la Ivermectina contra el virus del Zika (ZIKV) en ratones, pero los autores reconocieron que las limitaciones del estudio justificaron la reevaluación de la actividad anti-ZIKV de la Ivermectina (Ketkar et al., 2019).
Finalmente, la Ivermectina fue el foco de un ensayo clínico de fase III en Tailandia en 2014-2017, contra la infección por DENV, en el que se observó que una sola dosis oral diaria era segura y resultó en una reducción significativa de los niveles séricos de la proteína viralNS1, pero sin cambios en Se observó viremia o beneficio clínico (ver más abajo) (Yamasmith et al., 2018). El agente causante de la pandemia actual de COVID-19, SARS-CoV-2, es un virus de ARN de sentido positivo monocatenario que está estrechamente relacionado con severo coronavirus del síndrome respiratorio (SARS-CoV).
Los estudios sobre las proteínas SARS-CoV han revelado un papel potencial de IMPα / β1 durante la infección en el cierre nucleocitoplasmático dependiente de la señal de la proteína ucleocápsida del SARS-CoV (Rowland et al., 2005; Timani et al., 2005; Wulan et al., 2015), que puede afectar la división de la célula huésped (Hiscox et al., 2001; Wurm et al., 2001).
Además, se ha demostrado que la proteína accesoria de SARS-CoV ORF6 antagoniza la actividad antiviral del factor de transcripción STAT1 secuestrando IMPα / β1 en el ER rugoso / Golgimembrana (Frieman et al., 2007).
En conjunto, estos informes sugirieron que la actividad inhibidora del transporte nuclear de la Ivermectina puede ser eficaz contra el SARS-CoV-2.
Para probar la actividad antiviral de la Ivermectina contra el SARS-CoV-2, infectamos células Vero / HSLAM con el aislado de SARS-CoV-2 Australia / VIC01 / 2020 a una MOI de 0,1 durante 2 h, seguido de la adición de Ivermectina 5μM. El sobrenadante y los sedimentos celulares se recolectaron en los días 0 a 3 y se analizaron mediante RT-PCR para la replicación del ARN del SARS-CoV-2 (Fig. 1 A / B).
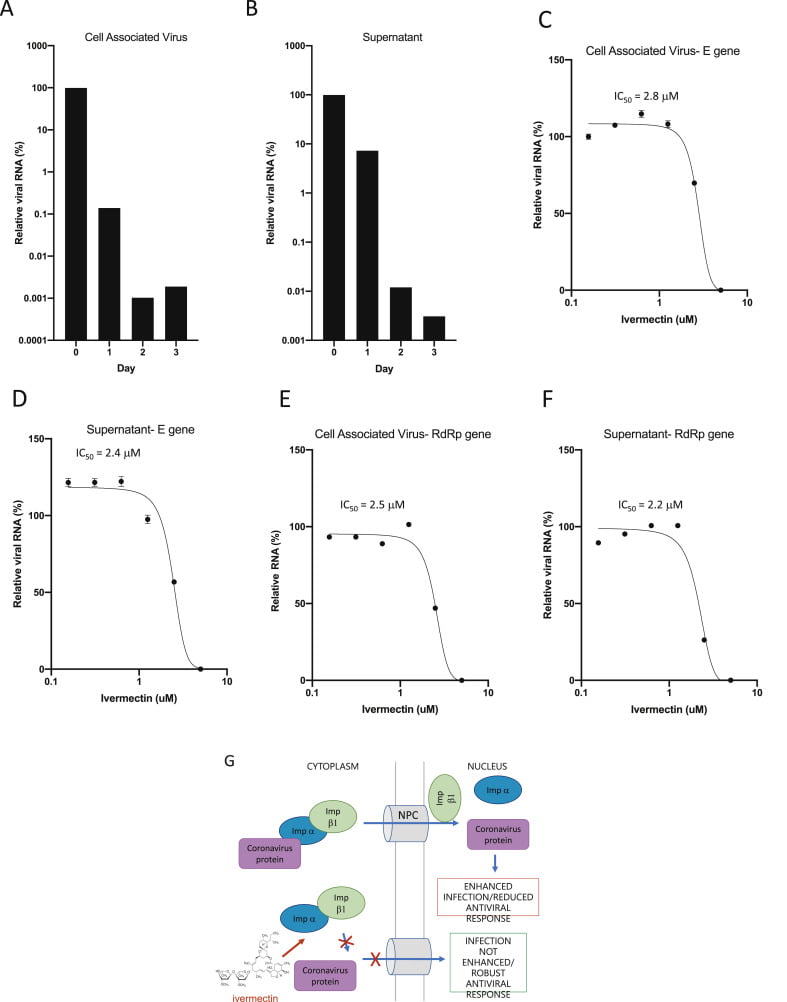
Fig. 1. La «Ivermectina es un potente inhibidor del aislado clínico de SARS-CoV-2» Australia / VIC01 / 2020. Las células Vero / HSLAM se infectaron con el aislado clínico de SARS-CoV-2 Australia / VIC01 / 2020 (MOI = 0,1) durante 2 h antes de la adición de vehículo (DMSO) o Ivermectina a las concentraciones indicadas. Se tomaron muestras entre 0 y 3 días después de la infección para cuantificar la carga viral mediante PCR en tiempo real del virus asociado a células (A) o sobrenadante (B). Los valores de CI50 se determinaron en experimentos posteriores a las 48 h después de la infección usando las concentraciones indicadas de Ivermectina (tratada a las 2 h después de la infección según A / B). Se realizó un análisis de PCR en tiempo real por triplicado una vez que todos los virus asociados (C / E) o el sobrenadante (D / F) se utilizaron contra los genes SARS-CoV-2 E (C / D) o RdRp (E / F). Los resultados representan la media ± DE (n = 3).
Se ajustaron las curvas de respuesta a la dosis de 3 parámetros utilizando el prisma GraphPad para determinar los valores de CI50 (indicados). G. Esquema de la acción antiviral propuesta por Ivermectina sobre el coronavirus. IMPα / β1 se une a la proteína cargo de coronavirus en el citoplasma (arriba) y la transloca a través del complejo de poros nucleares (NPC) hacia el núcleo, donde el complejo se deshace y la carga viral puede reducir la respuesta antiviral de la célula huésped, lo que conduce a una mayor infección. La Ivermectina se une al heterodímero Impα / β1 y lo desestabiliza, lo que impide que Impα / β1 se una a la proteína viral (parte inferior) y evita que entre en el núcleo. Esto probablemente da como resultado una inhibición reducida de las respuestas antivirales, lo que conduce a una respuesta antiviral normal y más eficiente.
A las 24 h, hubo una reducción del 93 % en el ARN viral presente en el sobrenadante (indicativo de viriones liberados) de las muestras tratadas con Ivermectina en comparación con el vehículo DMSO. De manera similar, se
observó una reducción del 99,8 % en el ARN viral asociado a células (indicativo de virus no liberados y no empaquetados) con el tratamiento con Ivermectina. A las 48 h, este efecto aumentó a una reducción de ~ 5000
veces del ARN viral en las muestras tratadas con Ivermectina en comparación con las muestras de control, lo que indica que el tratamiento con Ivermectina dio como resultado la pérdida efectiva de prácticamente todo el material viral a las 48 h. De acuerdo con esta idea, no se observó ninguna reducción adicional en el ARN viral a las 72 h.
Como hemos observado anteriormente (Lundberg et al., 2013; Tay et al., 2013; Wagstaffet al., 2012), no se observó toxicidad de la Ivermectina en ninguno de los puntos de tiempo probados, ni en el pozo de la muestra ni en las muestras de fármaco solo probadas en paralelo.
Para determinar aún más la eficacia de la Ivermectina, las células infectadas con SARS-CoV-2 se trataron con diluciones seriadas de Ivermectina 2 Hpost infección y el sobrenadante y los sedimentos celulares recogidos para RT-PCR en tiempo real a las 48 h (Fig. 1C / D). Como anteriormente, se observó una reducción> 5000 en el ARN viral tanto en el sobrenadante como en los sedimentos celulares de las muestras tratadas con Ivermectina 5 μM a las 48 h, lo que equivale a una reducción del 99,98 % en el ARN viral en estas muestras.
Nuevamente, no se observó toxicidad con Ivermectina en ninguna de las concentraciones probadas. Se determinó que la CI50 del tratamiento con Ivermectina era ~ 2 μM en estas condiciones. Subrayando el hecho de que el ensayo detectó específicamente el SARS-CoV-2, los experimentos de RT-PCR se repitieron utilizando cebadores específicos para el gen RdRp viral (Fig. 1E / F) en lugar del gen E (arriba), con resultados casi idénticos observados para ambos liberados (sobrenadante) y virus asociados a células.
Tomados en conjunto, «estos resultados demuestran que la Ivermectina tiene acción antiviral contra el aislado clínico de SARS-CoV-2 in vitro», con una sola dosis capaz de controlar la replicación viral dentro de las 24-48 h en nuestro sistema.
Presumimos que esto probablemente se deba a la inhibición de la importación nuclear de proteínas virales mediada por IMPα / β1 (Fig. 1G), como se muestra para otros virus de ARN (Tay et al., 2013; Wagstaffet al., 2012; Yang et al., 2020); confirmación de este mecanismo en el caso del SARS-CoV-2, y la identificación del SARS-CoV-2 específico y/ o componente (s) del huésped afectado (s) (ver (Yang et al., 2020)) es un factor importante. centrar el trabajo futuro en este laboratorio.
En última instancia, el desarrollo de un antivírico eficaz para el SARS-CoV- 2, si se administra a los pacientes al inicio de la infección, podría ayudar a limitar la carga viral, prevenir la progresión grave de la enfermedad y limitar la transmisión de persona a persona.
Pruebas de evaluación comparativa de Ivermectina frente a otros antivirales potenciales para el SARS-CoV-2 con mecanismos de acción alternativos (Dong et al., 2020; Elfiky, 2020; Gordonet al., 2020; Li y De Clercq, 2020; Wang et al., 2020) sería importante tan pronto como sea posible.
Este Breve Informe plantea la posibilidad de que la Ivermectina pueda ser un antiviral útil para limitar el SARS-CoV-2, de manera similar a los ya informados (Dong et al., 2020; Elfiky, 2020; Gordon et al., 2020; Li y DeClercq, 2020; Wang et al., 2020); Hasta que se demuestre que uno de estos es beneficioso en un entorno clínico, todos deben realizarse lo más rápido posible.
La «Ivermectina tiene un perfil de seguridad establecido para uso humano» (González Canga et al., 2008; Jans et al., 2019; Buonfrate et al., 2019), y «está aprobada por la FDA para una serie de infecciones parasitarias» (González Canga et al., 2008; Buonfrate et al., 2019).
Es importante destacar que las revisiones y los metanálisis recientes indican que la Ivermectina en dosis altas tiene
una seguridad comparable con el tratamiento estándar en dosis bajas, aunque «no hay suficiente evidencia para sacar conclusiones sobre el perfil de seguridad en el embarazo» (Navarro et al., 2020; Nicolas et al., 2020).
El siguiente paso crítico en una evaluación adicional para un posible beneficio en pacientes con COVID-19 será examinar un régimen de dosificación de adición múltiple que imite el uso actual aprobado de Ivermectina en humanos.
Como se señaló, la «Ivermectina fue el foco de un reciente ensayo clínico de fase III en pacientes con dengue en Tailandia», en el que se descubrió que una sola dosis diaria era segura pero no produjo ningún beneficio clínico. Sin embargo, los investigadores señalaron que se podría desarrollar un régimen de dosificación mejorado, basado en datos farmacocinéticos (Yamasmith et al., 2018). Aunque DENV es claramente muy diferente a SARS-CoV-2, el diseño de este ensayo debería informar el trabajo futuro en el futuro.
En conjunto, el informe actual, combinado con un perfil de seguridad conocido, demuestra que la Ivermectina merece una consideración adicional como un posible SARS-CoV-2 antivírico.
2. Métodos
2.1. Cultivo celular, infección viral y tratamiento farmacológico Las células Vero / HSLAM (Ono et al., 2001) se mantuvieron en Medio Esencial Mínimo (EMEM) de Earle que contenía 7 % de Suero Bovino Fetal (FBS) (Bovogen Biologicals, Keilor East, AUS) 2 mM L-Glutamina, piruvato de sodio 1 mM, 1500 mg / L de bicarbonato de sodio, 15 mMHEPES y 0.4 mg / ml de genetina a 37 ° C, 5 % de CO2. Las células se sembraron en placas de cultivo de tejidos de 12 pocillos 24 h antes de la infección con SARS-CoV-2 (aislado de Australia / VIC01 / 2020) a una MOI de 0,1 en los medios de infección (según los medios de mantenimiento, pero que contenían solo 2 % de FBS) durante 2 h. El medio que contenía inóculo se retiró y se reemplazó con 1 ml de medio fresco (2% de FBS) que contenía Ivermectina en las concentraciones indicadas o DMSO solo y se incubó como se indica durante 0 a 3 días. En el momento apropiado, se recogió el sobrenadante celular y se centrifugó durante 10 min a 6.000 g para eliminar los desechos y el sobrenadante se transfirió a tubos de recolección nuevos. Las monocapas de células se recogieron raspando y resuspendiendo en 1 ml de medio fresco (FBS al 2 %). Los controles de toxicidad se establecieron en paralelo en cada experimento en células no infectadas.
2.2. La generación de ADNc de SARS-CoV-2 se extrajo de alícuotas de 200 μl de sobrenadante de muestra o suspensión celular utilizando el kit QIAamp 96 Virus QIAcube HT (Qiagen, Hilden, Alemania) y eluyó en 60 μl. La transcripción inversa se realizó utilizando el kit de ADNc BioLine SensiFAST (Bioline, Londres, Reino Unido), mezcla de reacción total (20 μl), que contenía 10 μl de extracto de ARN, 4 μl de tampón TransAmp 5x, 1 μl de transcriptasa inversa y 5 μl de agua libre de nucleasa. Las reacciones se incubaron a 25 ° C durante 10 min, 42 ° C durante 15 min y 85 ° C durante 5 min.
2.3. Detección de SARS-CoV-2 mediante un ensayo de RT-PCR en tiempo real TaqMan El ensayo de RT-PCR de TaqMan se realizó utilizando 2,5 μl de cDNA, 10 μl de diseño de primario Precisión PLUS qPCR Master Mix 1 μM Forward (5′- AAATTC TAT GGT GGT TGG CAC AAC ATG TT- 3 ′), cebadores inversos de 1 μM (5′- TAGGCA TAG CTC TRT CAC AYT T-3 ′) y sonda de 0,2 μM (5′-FAM-TGG GTT GGG ATT ATC-MGBNFQ-3 ′) dirigidos a BetaCoV RdRp (RNA- ARN polimerasa dependiente) o Forward (5′-ACA GGT ACG TTA ATA GTT AAT AGC GT -3 ′), cebadores inversos 1μM (5′-ATA TTG CAG CAGTAC GCA CAC A-3 ′) y sonda 0,2μM (5′-FAM-ACA CTA GCCATC CTT ACT GCG CTT CG-286 NFQ -3 ‘) que se dirige al gen BetaCoV E (Corman et al., 2020). Los ensayos de RT-PCR en tiempo real se realizaron en una máquina de PCR en tiempo real Applied Biosystems ABI 7500 Fast (Applied Biosystems, Foster City, CA, EE. UU.) Utilizando condiciones de ciclo de 95 ° C durante 2 min, 95 ° C durante 5 s, 60 ° C durante 24 s. Se usó ADNc de SARS-CoV-2 (Ct ~ 28) como control positivo.
Los valores de Ct calculados se convirtieron en una reducción de veces de las muestras tratadas en comparación con el control usando el método methodCt (veces cambiado en el ARN viral = 2 ^ ΔCt) y se expresaron como % de DMSO sola muestra. Los valores de CI50 se ajustaron utilizando curvas de respuesta a la dosis de 3 parámetros en el prisma GraphPad.
El Financiamiento de este trabajo fue apoyado por una beca de la Fundación Nacional del Cáncer de Mama, Australia (ECF-17-007) para KMW y un Consejo Nacional de Investigación Médica y de Salud (NHMRC), Australia Senior Investigadora Principal (SPRF) (APP1103050) para DAJ.
Referencias
Buonfrate, D., et al., 2019. Multiple-dose versus single-dose ivermectin for Strongyloidesstercoralis infection (Strong Treat 1 to 4): a multicentre, open-label, phase 3, ran-domised controlled superiority trial. Lancet Infect. Dis. 19 (11), 1181–1190.Caly, L., Wagstaff, K.M., Jans, D.A., 2012. Nuclear trafficking of proteins from RNAviruses: potential target for anti-virals? Antivir. Res. 95, 202–206.Corman, V.M., et al., 2020. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 25 (3).Dong, L., Hu, S., Gao, J., 2020. Discovering drugs to treat coronavirus disease 2019 (COVID-19). Drug Discov. Ther. 14 (1), 58–60.Elfiky, A.A., 2020. Anti-HCV, nucleotide inhibitors, repurposing against COVID- 19. LifeSci. 248, 117477.Frieman, M., et al., 2007. Severe acute respiratory syndrome coronavirus ORF6 antag-onizes STAT1 function by sequestering nuclear import factors on the rough en-doplasmic reticulum/Golgi membrane. J. Virol. 81 (18), 9812–9824.Gonzalez Canga, A., et al., 2008. The pharmacokinetics and interactions of ivermectin inhumans–a mini-review. AAPS J. 10 (1), 42–46.Gordon, C.J., et al., 2020 Apr 10. The antiviral compound remdesivir potently inhibitsRNA-dependent RNA polymerase from Middle East respiratory syndrome cor-onavirus. J. Biol. Chem. 295 (15), 4773–4779.Gotz, V., et al., 2016. Influenza A viruses escape from MxA restriction at the expense ofefficient nuclear vRNP import. Sci. Rep. 6, 23138.Hiscox, J.A., et al., 2001. The coronavirus infectious bronchitis virus nucleoprotein lo-calizes to the nucleolus. J. Virol. 75 (1), 506–512.Jans, D.A., Martin, A.J., Wagstaff, K.M., 2019. Inhibitors of nuclear transport. Curr. Opin.Cell Biol. 58, 50–60.Ketkar, H., et al., 2019. Lack of efficacy of ivermectin for prevention of a lethal Zika virusinfection in a murine system. Diagn. Microbiol. Infect. Dis. 95 (1), 38–40.Kosyna, F.K., et al., 2015. The importin alpha/beta-specific inhibitor Ivermectin affectsHIF- dependent hypoxia response pathways. Biol. Chem. 396 (12), 1357–1367.Li, G., De Clercq, E., 2020.
Therapeutic options for the 2019 novel coronavirus (2019-nCoV). Nat. Rev. Drug Discov. 19 (3), 149–150. Lundberg, L., et al., 2013. Nuclear import and export inhibitors alter capsid proteindistribution in mammalian cells and reduce Venezuelan Equine Encephalitis Virusreplication. Antivir. Res. 100 (3), 662–672.Lv, C., et al., 2018. Ivermectin inhibits DNA polymerase UL42 of pseudorabies virusentrance into the nucleus and proliferation of the virus in vitro and vivo. Antivir. Res.159, 55–62.Mastrangelo, E., et al., 2012 Aug. Ivermectin is a potent inhibitor offlavivirus replicationspecificallytargeting NS3 helicase activity: new prospects for an old drug. J.Antimicrob. Chemother. 67 (8), 1884–1894.Navarro, M., et al., 2020. Safety of high-dose ivermectin: a systematic review and meta-analysis. J. Antimicrob. Chemother. 75 (4), 827–834.Nicolas, P., et al., 2020. Safety of oral ivermectin during pregnancy: a systematic reviewand meta-analysis. Lancet Global Health 8 (1), e92–e100.Ono, N., et al., 2001. Measles viruses on throat swabs from measles patients use signalinglymphocytic activation molecule (CDw150) but not CD46 as a cellular receptor. J.Virol. 75 (9), 4399–4401.Rowland, R.R., et al., 2005. Intracellular localization of the severe acute respiratorysyndrome coronavirus nucleocapsid protein: absence of nucleolar accumulationduring infection and after expression as a recombinant protein in vero cells. J. Virol.79 (17), 11507–11512.Tay, M.Y., et al., 2013. Nuclear localization of dengue virus (DENV) 1-4 non-structuralprotein 5; protection against all 4 DENV serotypes by the inhibitor Ivermectin.Antivir. Res. 99 (3), 301–306.Timani, K.A., et al., 2005. Nuclear/nucleolar localization properties of C-terminal nu-cleocapsid protein of SARS coronavirus. Virus Res. 114 (1–2), 23–34.van der Watt, P.J., et al., 2016. Targeting the nuclear import receptor Kpnbeta1 as ananticancer therapeutic. Mol. Canc. Therapeut. 15 (4), 560–573.Wagstaff, K.M., et al., 2011. An AlphaScreen(R)-based assay for high-throughputscreening for specific inhibitors of nuclear import. J. Biomol. Screen 16 (2), 192–200.Wagstaff, K.M., et al., 2012. Ivermectin is a specific inhibitor of importin alpha/beta-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus.Biochem. J. 443 (3), 851–856.Wang, M., et al., 2020. Remdesivir and chloroquine effectively inhibit the recentlyemerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 30 (3), 269–271.Wulan, W.N., et al., 2015. Nucleocytoplasmic transport of nucleocapsid proteins of en-veloped RNA viruses. Front. Microbiol. 6, 553.Wurm, T., et al., 2001. Localization to the nucleolus is a common feature of coronavirusnucleoproteins, and the protein may disrupt host cell division. J. Virol. 75 (19),9345–9356.Yamasmith, E., et al., 2018.
Efficacy and safety of ivermectin against dengue infection: aphase III, randomized, double-blind, placebo- controlled trial. In: He 34th AnnualMeeting the Royal College of Physicians of Thailand. Internal Medicine
and OneHealth, Chonburi, Thailand.Yang, S.N.Y., et al., 2020. The broad spectrum antiviral ivermectin
targets the host nu-clear transport importin alpha/beta1 heterodimer. Antivir. Res. 104760.
Link de la versión en inglés:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7129059/
*